Ehemalige Forschungsschwerpunkte:
Auswirkungen von Radon-Bestrahlung im Niedrigdosisbereich
Prof. Dr. Claudia Fournier
Neben Photonen wird in Niedrigdosis - Strahlentherapie dicht ionisierender Strahlung z.B. in Radonbädern verwendet, um rheumatoide Arthritis, ankylosierende Spondylitis, muskuloskelettale Störungen, Schuppenflechte und andere Krankheiten zu behandeln (Abbildung 1). Die zellulären und molekularen Mechanismen, die der beobachteten Schmerzmilderung in Radonbädern zugrunde liegen, sind unbekannt.

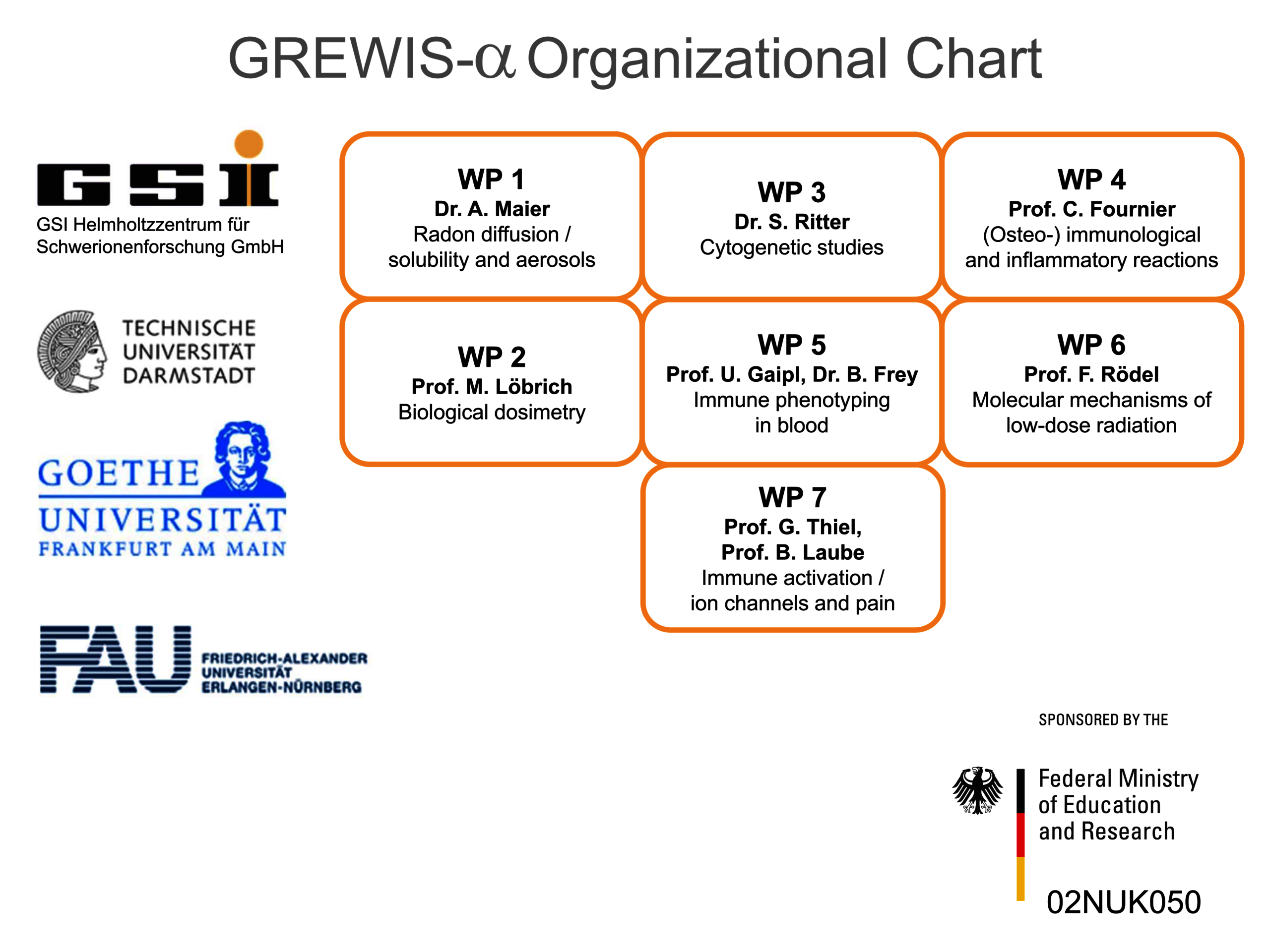
GREWIS / GREWIS-alpha Konsortium
Daher begannen wir, die potentiell hilfreichen und gefährlichen Aspekte niedrig dosierter Radon-Exposition zu untersuchen. Um dies zu erreichen, arbeiten wir im Rahmen des GREWIS-Projektes mit Experten aus den Bereichen der Teilchenphysik, Zytogenetik, DNA-Reparatur, Immunologie und der molekularen Zellbiologie- und Physiologie zusammen, s. Helmholtz-Gemeinschaft. Das GREWS-alpha Konsortium umfasst sieben Arbeitsgruppen von vier Institutionen und assoziierten medizinischen Kooperationspartnern (Abbildung 2).

Prof. Dr. Claudia Fournier, Dr. Andreas Maier, Dr. Denise Eckert, Dr. Ayele Taddese Tsedeke
Die Forschungsgruppen der GREWIS-Projekte haben eine gemeinsame Strategie entwickelt, um verschiedene Aspekte des Risikos und des potentiell immunmodulierenden Effektes niedriger Strahlungsdosen zu untersuchen.
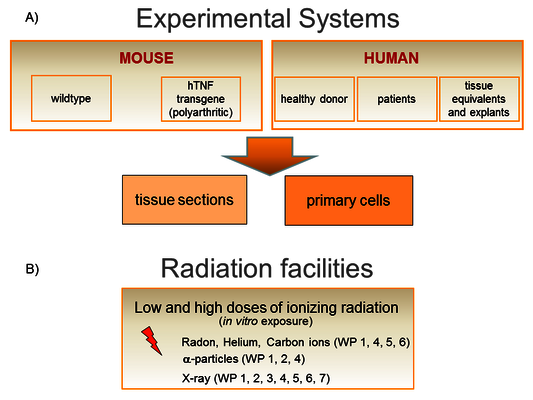
Wir arbeiten sowohl auf molekularer und zellulärer Ebene, als auch an Geweben und Tiermodellen (Abbildung 3A). Außerdem haben wir Zugang zu menschlichem Knochenmark (hämatopoetische und mesenchymale Stammzellen), Haut von gesunden Spendern, humane Kniegewebeproben (infrapatellare Fettpolster and Synovialmembran) und Blut von Patienten in der Radontherapie in der Radontherapie (RAD‐ON02, EudraCT 2016‐002085‐31) und der IMMO-LDRT-Studie (niedrigen Dosen Röntgenstrahlung) (IMMO‐LDRT; NCT02653079).
Für die Radonexposition wurde eine Kammer für die Exposition von Zellkulturen und Mäusen, mit kontrollierten Parametern wie Luftfeuchtigkeit, Temperatur und Radonkonzentration entwickelt. So können vergleichbare Bedingungen wie während einer Radontherapie und auch darüber hinaus eingestellt werden (Abbildung 4, zum Vergrößern klicken) [1]. Zur Bestimmung des Diffusions- und Löslichkeitsverhaltens von Radon wurden Messverfahren und Auswertealgorithmen entwickelt [2]. Mittels molekulardynamischer Simulationen konnte zusätzlich eine ungleiche Verteilung von Radon zwischen Fettsäuren und isotoner Kochsalzlösung mechanistisch erklärt werden [3]. Zusätzlich wurde ein Aufbau zur Bestrahlung von Zellkulturen mit α-Teilchen konstruiert, welcher an der GSI und der TU Darmstadt verfügbar ist. Dazu wird eine Americium-241 Quelle verwendet, die eine vergleichbare α-Energie wie Radon-222 hat. Mit dieser können die Zellen auf dünnen Folien für definierte Zeitintervalle bestrahlt werden [4]. Außerdem nutzen wir schwere Ionen (Helium- und Kohlenstoff-Ionen) mit ähnlichen Charakteristiken wie die der α-Teilchen (Abbildung 3B).
Um die Dosis und damit auch das Risiko einer Radonexposition abschätzen zu können, wurde Messungen an einem freiwilligen Patienten nach der Heilstollentherapie durchgeführt. Die hier entwickelten Auswertemodelle können auf andere Anwendungen angewandt werden, beispielsweise zur Dosisabschätzung im Mausmodell oder in physikalischen Proben.
Biodosimetrie basierend auf DNA-Schadensmarkern nach Radonexposition wurde für verschiedene Organe etabliert und Referenzkurven mit Röntgenstrahlung gemessen. Da Blutgefäße ebenso wie die Interaktion von Endothelzellen der Blutgefäßwände und hämatopoetische Zellen eine Schlüsselrolle in den ersten Schritten der Immunantwort spielen, wurde eine Fließkammer konstruiert, um den Scherstreß des Blutflusses zu imitieren. Experimente werden in vitro mit humanen und murinen Primärzellen durchgeführt (hämatopoetische, Haut-, Knochen, Synovial- und Fettzellen; differenziert von Stamm- und Progenitorzellen von gesunden Spendern), sowie mit 3D Gewebeäquivalenten. In einem in vivo Ansatz werden das hTNF-α-transgene Mausmodell und das K/BxN Serumtransfermodell für Polyarthritis genutzt, um die Reifung und Aktivität von Immun- und Knochenzellen zu untersuchen.
Eine erste RAD-ON01 Studie hat gezeigt, dass Patienten nach einer Radonbehandlung verminderte Schmerzen aufweisen. Dies könnte auf eine Abnahme der Anzahl und der Aktivität von knochenresorbierenden Osteoklasten zurückzuführen sein und hat sich auch in der Patientenstudie zu Photonenstrahlung (IMMO-LDRT) bestätigt. Ebenso konnte im Plasma von Radon- und LDRT-Patienten ein Rückgang der Kollagen-Fragmente und eine geringere Aktivität eines am Knochenabbau beteiligten Enzyms (TRAP) nachgewiesen werden. In einer zweiten, laufenden RAD-ON02 Studie, wurde nun erstmals ein Cross-Over Design angewendet, d.h. es gibt an zwei aufeinanderfolgenden Jahren mit jeweils den gleichen 100 Patienten jeweils eine Kontrollgruppe und eine Gruppe von Radon-exponierten Patienten. Dadurch soll ein möglicher Placebo-Effekt sichtbar gemacht werden. Nach einem Jahr werden die Patienten erneut behandelt, die Gruppen aber getauscht. Die Studie ist verblindet, d.h. es ist nicht weder Patienten, Ärzten noch den Forschern bekannt, welche Gruppe welche Behandlung bekommen hat. Dies ist vereinbar mit beobachteten funktionellen Änderungen infolge von Niedrigdosis – Photonenexposition (LDRT) im Polyarthritis - Mausmodell und den in vitro - Resultaten auf der molekularen Ebene (Abbildung 5, klicken zum Vergrößern) [5-14]. Der aktuelle Wissensstand zur möglichen Wirkung und dem Risiko einer Radontherapie wurde in einem Review zusammengefasst und publiziert [15].
GREWIS-verbundene Forschungsaktivitäten in unserer Gruppe


Strahlenantworten von humanen hämatopoetischen Stamm- und Progenitorzellen
Dr. Daniela Kraft
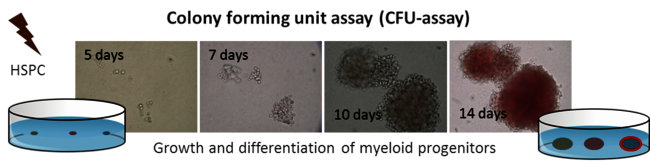
Sekundäre Krebserkrankungen ereignen sich Monate bis Jahre nach Einwirkung und sind ein wichtiges Thema im Strahlenschutz, für Strahlentherapie und bemannte Weltraummissionen. Einflüsse auf Prozesse der Selbsterneuerung und Differenzierung von hematopoetischen Stamm - und Progenitorzellen (HSPC) durch Strahleneinwirkung werden als Ursache für ein erhöhtes Risiko von strahleninduzierter Leukämie angenommen (rAML). Jedenfalls benötigt man für die Risikoeinschätzung für strahleninduzierte Leukämogenese vertiefte Kenntnisse über die Strahlenantworten von HSPC, insbesondere im Bezug auf deren genetischer Stabilität.
Daher untersuchten wir die Übertragung von chromosomalen Änderungen in HSPC, die Strahlung von niedrigem und hohem LET (bis zu 85 keV/µM) ausgesetzt waren. In Anbetracht bekannter Unterschiede im Bezug auf die genetische Stabilität und DNA - Reparaturfähigkeit zwischen murinen und humanen HSPC benutzten wir humane HSPC im Zuge einer Kooperation mit Prof. H. Bönig (Universität Frankfurt) (Abbildung 10, Anklicken zum Vergrößern). Unsere Resultate zeigten unabhängig vom LET keine chromosomale Instabilität, aber eine erhebliche Frequenz von klonalen chromosomalen Aberrationen in den Nachkommen bestrahlter HSPC [19, 20]. Um die Kapazität von HSPC zu korrekter DNA Reparatur zu durchleuchten, untersuchten wir die Qualitäten und molekularen Komponenten der Doppelstrangbruch (DSB) -reparatur im Vergleich zu reifen peripheren Blut-Lymphozyten mit Hilfe eines EGF - Plasmid - Reportersystems in HSPC in Kollaboration mit Prof. Dr. Wiesmüller (Universität Ulm). Wir konnten zeigen, dass HSPC eine DSB - Reparaturdefizienz durch vermindertes NFkB - Signaling zeigen (homologe Rekombination), was durch Schwerionenexposition bestätigt wurde und das Auftreten von klonalen Aberrationen in den folgenden Generationen nach der Exposition erklären konnte [21, 22].
Kürzlich starteten wir Untersuchungen zur Kombination von Mikroschwerkraft und hoch LET - Exposition in HSPC.
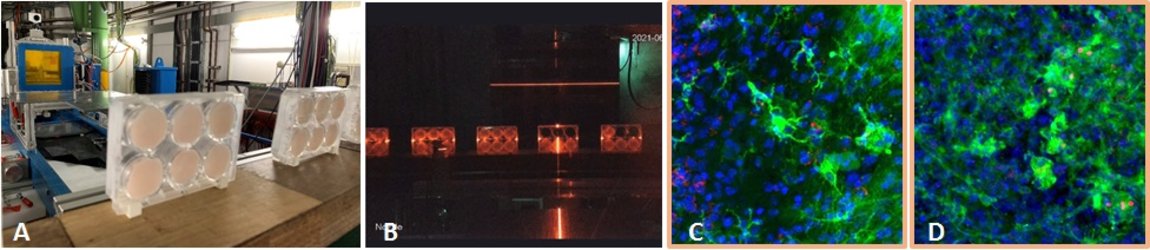
Neuroinflammation durch Weltraumstrahlung
Dr. Felicitas Rapp
Für einen geplanten längeren Weltraumaufenthalt, zum Beispiel bei einer zukünftigen Mission zum Mars, ist es wichtig, die Risiken für Astronaut*innen zu kennen. Wir untersuchen in einem Projekt, das von ESA und DLR finanziert wird, ob sich eine strahleninduzierte Neuroinflammation durch Testsubstanzen vermindern lässt. Hierzu verwenden wir ein organotypisches Hippocampus-Modell von Mäusen. Diese Hippocampus-Slice-Kulturen werden ex vivo mit weltraumrelevanten Schwerionen (Eisen-Ionen, Fe) bestrahlt und anschließend mit Testsubstanzen behandelt (Abb. 11 A+B). Danach nehmen wir zu verschiedenen Zeitpunkten, bis zu 29 Tage nach Bestrahlung, Proben und analysieren die Entzündungsreaktion. Diese wird vor allem durch die hirnständigen Immunzellen, die Mikroglia, vermittelt, so dass diese im Fokus unserer Arbeit sind. Wir haben ein System entwickelt, in dem die Mikroglia angefärbt und hinsichtlich ihrer entzündlichen Aktivierung durch konfokale Mikroskopie morphologisch ausgewertet werden (Abb. 11 C+D). Dieses Projekt wird in Zusammenarbeit mit Dr. Sonja Kallendrusch und Prof. Ingo Bechmann (Institut für Anatomie, Universität Leipzig) durchgeführt. In Zukunft ist es geplant, diese Ergebnisse auf ein Mausmodell zu übertragen und die Auswirkungen der Weltraumstrahlung bzw. die Behandlung durch unsere Testsubstanzen auf die kognitiven Fähigkeiten der Mäuse zu erfassen. Hierbei sollen auch neuartige Methoden zur physikalischen Strahlungs-Abschirmung untersucht werden. Dieser Teil des Projekts wird zusammen mit Prof. Chiara LaTessa (Universität Trento, Italien) durchgeführt.
Durch Schwerionen induzierte späte Effekte in Gewebe
Dr. Julia Wiedermann
In anderen Projekten studiert unsere Gruppe späte Effekte durch Schwerionenexposition. Strahleninduzierte nichtmaligne Effekte beinhalten den Einfluss auf die Funktionalität von Geweben und Organen, der oft durch den Verlust von funktionalen Zellen oder Modifikationen im Differenzierungsprozess und folgender Reorganisation des Gewebes ausgelöst wird.
Die resultierenden Änderungen können Entzündungen erzeugen, also einen physiologischen Reparaturprozess, der im Fall von Fibrose chronisch werden kann. Die zunehmende Anwendung von geladenen Teilchen in der Strahlentherapie erfordert ein besseres Verständnis dieser Prozesse, insbesondere im Fall von Kohlenstoffionen.
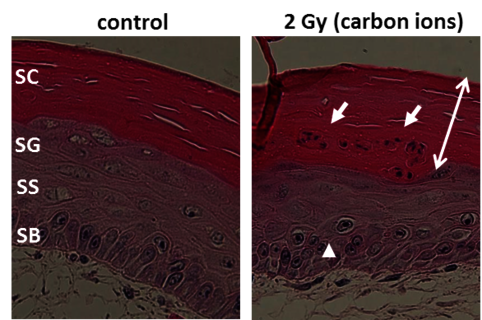
Insbesondere Haut ist in vielen Szenarien Strahlung ausgesetzt. Wir untersuchen in einem anderen Projekt die frühe Antwort der Haut auf Kohlenstoff-Ionen-Exposition, deren molekulare Basis nicht gut verstanden ist. Um bisherige RBE Datensätze aus einem Schweinemodell [23] mit zellulären und molekularen Studien zu vervollständigen, nutzen wir mono- und Cokulturen von epidermalen Zellen einem Voll-Haut 3D Gewebe-Äqivalent, und ex vivo bestrahlte humane Haut von gesunden Spendern, bereitgestellt von unseren Kollaborationspartnern PD Dr. M. Podda und M. Kovacs (Klinikum Darmstadt) (Abbildung 12, klicken zum Vergrößern). Ähnlich zu Photonenexposition wurde die epidermale Gewebeorganisation bei niedrigen und die Differenzierung bei hohen Dosen von Kohlenstoffionen modifiziert, mit einer moderaten Erhöhung von inflammatorischen Zytokinen [24]. In laufenden Experimenten werden die Resultate in mit Kohlenstoffionen bestrahlter Schweinehaut verifiziert.
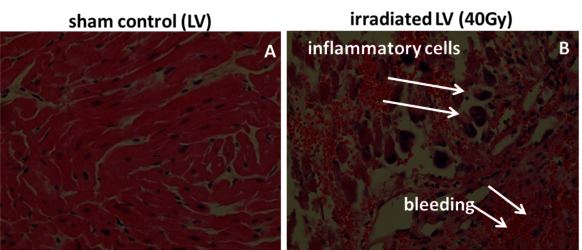
Diese Schweinehautproben wurden im Zuge von Experimenten im Rahmen einer Kollaboration mit MD I. Lehmann und MD D. Packer (Mayo Clinics, Rochester) erhalten, die der Erforschung der Möglichkeit der Behandlung von Herzrhythmusstörungen mit gezielter Partikelstrahlung gewidmet ist. Hierzu wurden zunächst isolierte Schweineherzen ex vivo bestrahlt und zelluläre sowie molekulare Änderungen analysiert [25]. Anschließend wurden Schweine mit Kohlenstoff-Ionen bestrahlt, um zu zeigen, dass gewisse Reizleitungsstrukturen im Herz gezielt durch Strahlung deaktiviert werden können. Anschließend untersuchten wir die bestrahlten Bereiche der Herzen und charakterisierten die entstandenen Schäden im Zielbereich sowie im Eingangskanal (mit Dr. P. Simoniello, Parthenope Universität von Neapel) [29] (Abbildung 13, klicken zum Vergrößern).
Referenzen:
[1] Maier et al., Nucl. Instr. Meth. Phys. Res. B, 362:187-193 (2015)
[2] Maier et al., Nucl. Instr. Meth. Phys. Res. B, 416:119-127 (2018)
[3] Sanjon et al., Scientific Reports 9,10768 (2019)
[4] Maier et al., Int. J. Radiat. Biol, 96:2, 206-213 (2020)
[5] Large et al., Rad. Oncology, 9:80 (2014)
[6] Large et al., Strahlenther Onkol, 191:742-749 (2015)
[7] Thangaraj et al., Chemico-Biological Interactions, 259B: 49-412 (2016)
[8] Roth et al., Pflügers Archive-European. J. Physiol. 467:1835-1849 (2014)
[9] Gibhardt et al., Scientific reports, 5:13861 (2015)
[10] Rühle et al., Autoimmunity, 50(2):133-140 (2017)
[11] Erbeldinger et al., Front Immunol., 8:627 (2017)
[12] Cucu et al., Front Immunol., 8:882 (2017)
[13] Maier et al., Nucl. Instr. Meth. Phys. Res. B, 416:119-127 (2018)
[14] Rühle et al., Modern Rheumatology, 29(1):165-172, (2019)
[15] Maier et al., Int. J. Mol. Sci. 22(1), 316 (2021)
[16] Ebner et al. 2017, Front Immunol., 8:99 (2017)
[17] Helm et al. 2018, Int J Part Ther., 5:84-93 (2018)
[18] Helm et al. 2021, Int J Radiat Oncol Biol Phys., 109:594-602 (2021)
[19] Kraft et al., Mutat. Res., 777:43-51 (2015)
[20] Becker et al., IJRB, 85(11):1051-1059 (2009)
[21] Kraft et al., Leukemia, 29:1543-1554 (2015)
[22] Rall et al., Frontiers in Oncology, 5:250 (2015)
[23] Zacharias et al., Acta Oncologica, 36(6):637–642 (1997)
[24] Simoniello et al., Frontiers in Oncology, 5:294 (2016)
[25] Lehmann et al., Circ Arrhythm Electrophysiol. 8(2):429-38 (2015)
[26] Rödel et al., Front Immunol. 8:519 (2017)
[27] Durante et al., Trends Mol. Med., 19(9):565–82 (2013)
[28] Shreder et al., Int. J. Mol. Sci.19(9), 2717 (2018)
[29] Rapp et al., Sci Rep 9(1):5000 (2019)
Mehr Informationen in:
- Rühle et al., Autoimmunity. 50(2):133-140 (2017)
- Rödel et al., Front Immunol. 8:519 (2017)
- Erbeldinger et al., Front Immunol. 8:627 (2017)
- Cucu et al., Front Immunol. 8:882 (2017)
- Eckert et al., Cells 11:72 (2022)
- Deloch et al., Cells 11:689 (2022)
- Papenfuss et al., Radiat Environ Biophys 61:279–292 (2022)
- Eckert et al., Front Immunol. 13:817281 (2022)