Forschungsschwerpunkte:
Immunmodulation von Strahlung und Kombinationstherapien
Dr. Alexander Helm
Ähnlich zu möglichen anti-inflammatorischen und immununterdrückenden Effekten von niedrigen Strahlendosen auf Organismen können höhere Strahlendosen Immunreaktionen auslösen, die das Behandlungsergebnis verbessern können. Solche Reaktionen will man sich insbesondere in der Therapie metastasierter Tumore zu Nutze machen und setzt daher auf eine Kombination aus Strahlung und Immuntherapien. In unseren Forschungsarbeiten untersuchen wir das Ansprechen von (strahlenresistenten) Tumorzellen auf Strahlung mit niedrigem und hohem LET (Linearem Energietransfer, Photonen versus Partikel), mit dem Ziel das Abtöten von Tumorzellen durch die Aktivierung einer Immunantwort zu unterstützen [16, 17]. In einem in vivo Modellsystem (Osteosarkom, Metastasen in der Lunge) konnten wir nachweisen, dass Kohlenstoffionen – in Kombination mit einer Immuntherapie (sog. Checkpoint Inhibitoren), aber auch allein – wirksamer Lungenmetastasen bekämpfen konnten als im Vergleich eingesetzte Photonen [18]. Unsere derzeitigen Forschungsaktivitäten widmen sich der Überprüfung dieser vielversprechenden Resultate in weiteren (humanen) Zelllinien sowie der Aufklärung involvierter Mechanismen und welche Rolle die Therapie mit Kohlenstoffionen dabei spielt. Wir untersuchen ebenso die Kombination von Kohlenstofftherapie mit verschiedenen Immuntherapien wie zum Beispiel mRNA Vakzine [19].
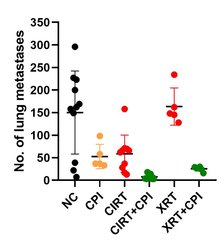
Kohlenstofftherapie (CIRT) alleine resultiert bereits in einer Verringerung der Lungenmetastasen in einem Osteosarkom in vivo Modell im Vergleich zur unbehandelten Kontrolle, was nicht der Fall ist, wenn mit konventioneller Strahlentherapie (Photonen, XRT) bestrahlt wird. Wenn zusätzlich Immuntherapie genutzt wird (Abbildung 1: zwei Arten von Checkpoint Inhibitoren, CPI, Anklicken zum Vergrößern), wird die immunogene Antwort verstärkt und die Zahl der Lungenmetastasen verringert sich weiter. Dies verdeutlich das enorme Potential von Kohlenstofftherapie in Verbindung mit Immuntherapie [17].
![Abbildung 2: Kohlenstofftherapie in Verbindung mit Immuntherapie (CIRT+CPI) führt zur verstärkten Infiltration von Immunzellen (CD8+ bzw. CD11b+) in den Tumor als bei unbehandelten Kontrollen (NC) [17]. Dr. Alexander Helm, GSI Helmholtzzentrum für Schwerionenforschung GmbH](/fileadmin/_processed_/c/5/csm_Immune_infiltration_Homepage_e2b474cabd.jpg)
Kohlenstoffionentherapie bei HPV-negativen Tumoren
Dr. Silvana Miranda
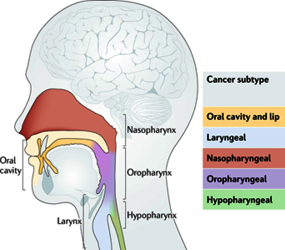
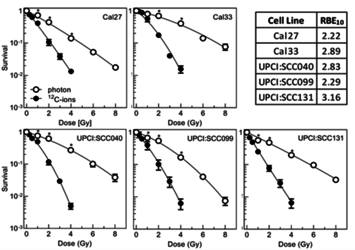
Kopf-Hals-Plattenepithelkarzinome (engl. Head and neck squamous cell carcinomas, HNSCC) umfassen eine Gruppe von bösartigen Tumoren, die nach ihrem anatomischen Ursprungsort klassifiziert werden (Abbildung 3. Sie gehören zu den weltweit häufigsten Krebsarten und stellen eine große globale Gesundheitsbelastung dar [20]. Die Strahlentherapie spielt eine wichtige Rolle bei der Behandlung von HNSCC, kann jedoch schwerwiegende Nebenwirkungen verursachen, die die Lebensqualität der Patienten erheblich beeinträchtigen [20,21]. Darüber hinaus weisen HNSCC eine ausgeprägte Heterogenität in ihrer Tumorbiologie auf, je nachdem, ob eine Infektion mit dem humanen Papillomavirus (HPV) vorliegt oder nicht [22]. HPV-positive Tumoren reagieren in der Regel empfindlicher auf Strahlung, werden vom Immunsystem besser erkannt und sprechen besser auf die Behandlung an [23,24]. HPV-negative Tumoren hingegen sind bekanntermaßen therapieresistenter, haben schlechtere klinische Ergebnisse und schaffen eine immunsuppressive Mikroumgebung [22,25]. Die Kohlenstoffionen-Strahlentherapie (CIRT) bietet aufgrund ihres umgekehrten Dosis-Tiefen-Profils eine hervorragende Dosisanpassung und schont das umliegende Gewebe, was insbesondere in der anatomisch komplexen Kopf- und Halsregion von großem Wert ist und dazu beiträgt, strahleninduzierte Nebenwirkungen zu vermeiden [26,27]. Darüber hinaus haben In-vitro-Studien eine verringerte Überlebensrate von HPV-negativen Zelllinien im Vergleich zur Photonenbestrahlung gezeigt (Abbildung 2) [28]. Darüber hinaus verursacht CIRT komplexe DNA-Schäden an den Krebszellen, aktiviert bestimmte Zelltodwege und induziert möglicherweise eine stärkere Aktivierung des Immunsystems im Vergleich zu herkömmlichen Strahlentherapieverfahren [27,29].
In unserer Forschung untersuchen wir, wie CIRT die Strahlenreaktionen, die Tumorkontrolle und die Immunaktivierungsmechanismen in einem Mundhöhlenkarzinom-Modell mit unterschiedlichem HPV-Hintergrund modulieren kann. Wir gehen diesen Fragen mit einem kombinierten In-vitro- und In-vivo-Ansatz nach, einschließlich Mundhöhlenkrebs-Zelllinien, die so verändert wurden, dass sie HPV-abgeleitete Onkoproteine exprimieren, die zur Untersuchung der Reaktionen des Immunsystems auf Strahlen verwendet werden.
Außerdem unterstützen wir unsere Kollegen aus anderen Arbeitsgruppen der Biophysik bei immunomodulatorischen Aspekten ihrer Forschungen.
Referenzen:
[16] Ebner et al. 2017, Front Immunol., 8:99 (2017)
[17] Helm et al. 2018, Int J Part Ther., 5:84-93 (2018)
[18] Helm et al. 2021, Int J Radiat Oncol Biol Phys., 109:594-602 (2021)
[19] Salomon et al. 2024, Int J Radiat Oncol Biol Phys., 119(3):936-945. doi: 10.1016/j.ijrobp.2023.12.042
[20] Mody et al. 2021, The Lancet., 398(10318):2289-2299. doi:10.1016/S0140-6736(21)01550-6
[21] Brook 2020, Radiat Oncol J. 2020;38(2):84-92. doi:10.3857/roj.2020.00213
[22] Ochoa et al. 2022, Cancers, 14(17):4321. doi:10.3390/cancers14174321
[23] Kimple et al. 2013, Cancer Res. 2013;73(15):4791-4800. doi:10.1158/0008-5472.CAN-13-0587
[24] Taneja et al. 2024, Oral Oncol Rep. 10:100451. doi:10.1016/j.oor.2024.100451
[25] Galati et al. 2022 Tumour Virus Res. 14:200245. doi:10.1016/j.tvr.2022.200245
[26] Scalliet et al. 2017 CERN Yellow Rep Sch Proc. 1:1-1. doi:10.23730/CYRSP-2017-001.1
[27] Helm et al. 2023 Strahlenther Onkol. 199(12):1225-1241. doi:10.1007/s00066-023-02158-7
[28] Tiwari et al. 2022 Front Oncol. 12. doi:10.3389/fonc.2022.878675
[29] Goodhead 1999 J Radiat Res (Tokyo). 1999;40(Suppl):S1-S13. doi:10.1269/jrr.40.S1
Mehr Informationen in:
- Rühle et al., Autoimmunity. 50(2):133-140 (2017)
- Rödel et al., Front Immunol. 8:519 (2017)
- Erbeldinger et al., Front Immunol. 8:627 (2017)
- Cucu et al., Front Immunol. 8:882 (2017)
- Eckert et al., Cells 11:72 (2022)
- Deloch et al., Cells 11:689 (2022)
- Papenfuss et al., Radiat Environ Biophys 61:279–292 (2022)
- Eckert et al., Front Immunol. 13:817281 (2022)