Forschung zur Strahlentherapie bei Hirntumoren: Entdeckung könnte Prävention von Strahlenschäden verbessern
14.04.2025 |
Ein internationales Forschungsteam hat in einer wegweisenden Studie einen bislang wenig verstandenen Mechanismus der Schädigung des Gehirns nach einer Strahlentherapie bei Hirntumoren aufgedeckt. Damit können radiologische Veränderungen bei Patient*innen, die wegen eines Hirntumor mit geladenen Teilchen oder Photonen behandelt werden, besser erklärt werden. Diese mechanistische Entdeckung könnte neue Wege zur Behandlung und Vorbeugung von Strahlenschäden eröffnen, die bisher häufig die Wirksamkeit einer Strahlentherapie einschränken. Die Abteilung Biophysik des GSI Helmholtzzentrums für Schwerionenforschung in Darmstadt war federführend an der Studie beteiligt.
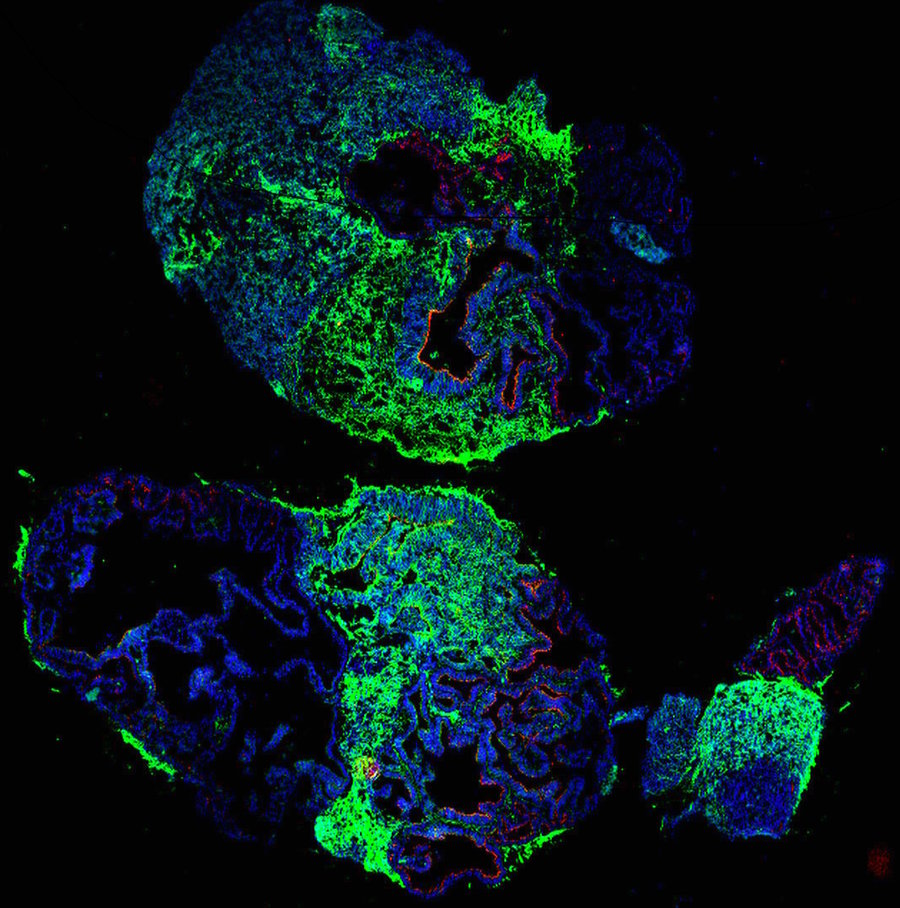
Mit Hilfe von zerebralen Organoiden (Mini-Gehirnen) konnten die Forschenden zeigen, dass die nach einer Strahlentherapie in MRT-Scans beobachteten Läsionen im Gehirn nicht auf das Absterben von Gehirnzellen (Hirnnekrose) selbst zurückzuführen sind, wie allgemein angenommen. Vielmehr werden sie durch eine abnorme Bildung von Plexus choroideus-artigen Zellen verursacht, die flüssigkeitsgefüllte Hohlräume säumen. Der Plexus choroideus (CP) ist für die Produktion von Liquor (Liquor cerebrospinalis) verantwortlich und zum Beispiel an Entgiftungsprozessen des Gehirns beteiligt. Daher lassen die beobachteten Hohlräume auf eine übermäßige Liqourproduktion schließen. Ihre Ergebnisse haben die Forschenden nun im Nature-Partner-Journal „Communications Biology“ veröffentlicht. Die Ergebnisse könnten dazu beitragen, die Nebenwirkung von Strahlentherapie besser zu verstehen und zu verhindern.
Die Arbeit wurde von den US National Institutes of Health (NIH) und dem Bundesforschungsministerium (BMBF) finanziert und von der GSI-Abteilung Biophysik unter der Leitung von Professor Marco Durante in Zusammenarbeit mit dem MD Anderson Krebszentrum der Universität von Texas und der Universität Heidelberg durchgeführt. Wichtiger Partner der Studie war außerdem das Heidelberger Ionenstrahl-Therapiezentrum (HIT).
Die Strahlentherapie ist eine wichtige Behandlungsmethode bei Hirntumoren, allerdings wird die Wirksamkeit der Behandlung durch ihre Toxizität für das normale Gewebe limitiert, einschließlich von Gewebeschädigungen (Läsionen) nach der Bestrahlung. Diese Läsionen treten bei bis zu 25Prozent der Patient*innen auf, die mit Strahlentherapie behandelt werden. Das Verständnis dieser Schäden und ihrer Ursachen war bislang unzureichend, was die Entwicklung von Gegenmaßnahmen erschwerte. Hier setzt die aktuelle Forschungsarbeit an, da sie zusätzliche Strategien für mögliche Gegenmaßnahmen liefern kann.
Professor Marco Durante, Leiter der GSI-Biophysik, fasst zusammen: „Diese Entdeckung verändert unser Verständnis der Strahlenschäden im Gehirn. Sie könnte eine Schlüsselrolle im Kampf gegen Strahlentoxizität spielen. Wenn wir die Mechanismen genauer verstehen, können wir auch neue Perspektiven für eine bessere Behandlung von Hirntumoren eröffnen.“ Ziel der Forschung ist es, Therapieansätze zu entwickeln, die schädliche Nebenwirkungen der Strahlentherapie auf das Gehirn minimieren, ohne die Wirksamkeit der Tumorbehandlung zu beeinträchtigen. Die Forschenden betonen, dass weitere Studien und klinische Tests erforderlich sein werden, um die potenziellen Umsetzungen dieser Entdeckung zu prüfen und therapeutische Lösungen zu entwickeln, die den Patient*innen zugutekommen. (BP)
Organiode
Wissenschaftler*innen setzen auf zerebrale Organoide, die in vitro („im Glas“, außerhalb des Körpers) mit Hilfe von menschlichen Stammzellen gezüchtet werden, um die Auswirkungen der Strahlentherapie auf das Gehirn zu untersuchen. Diese Organoide sind keine vollständig ausgebildeten Organe, ähneln aber in ihrer Struktur und Funktion dem menschlichen Gehirn und ermöglichen damit eine präzisere Untersuchung der Reaktionen des Gewebes auf Strahlung. Wissenschaftler*inne versprechen sich dabei einen substanziellen Fortschritt für Forschung und Therapie, nicht zuletzt bei neurologischen Erkrankungen.
Weitere Informationen
Veröffentlichung in „Communications Biology“